Autor:
Bobbie Johnson
Data De Criação:
10 Abril 2021
Data De Atualização:
1 Julho 2024
Contente
- Passos
- Parte 1 de 2: Prepare o equipamento
- Parte 2 de 2: conduza um experimento
- Pontas
- Avisos
- O que você precisa
Processo de divisão da água (H2O) em seus constituintes (hidrogênio e oxigênio) usando eletricidade é chamado de eletrólise. Os gases obtidos com a eletrólise podem ser usados isoladamente - por exemplo, o hidrogênio é uma das fontes de energia mais limpas. Embora o nome desse processo possa soar um pouco inteligente, na verdade é mais fácil do que pode parecer se você tiver o equipamento, o conhecimento e um pouco de experiência certos.
Passos
Parte 1 de 2: Prepare o equipamento
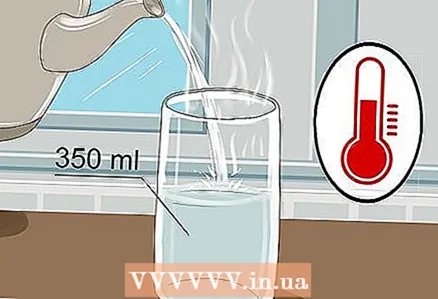 1 Pegue um copo de 350 ml e despeje água morna nele. Não há necessidade de encher o copo até a borda, basta um pouco de água. Água fria serve, embora água quente conduza melhor a eletricidade.
1 Pegue um copo de 350 ml e despeje água morna nele. Não há necessidade de encher o copo até a borda, basta um pouco de água. Água fria serve, embora água quente conduza melhor a eletricidade. - Água da torneira e água engarrafada servem.
- A água quente tem uma viscosidade mais baixa, o que torna mais fácil a movimentação dos íons.
 2 Dissolva 1 colher de sopa (20 gramas) de sal de cozinha na água. Despeje o sal em um copo e mexa a água para dissolver. Isso criará uma solução salina.
2 Dissolva 1 colher de sopa (20 gramas) de sal de cozinha na água. Despeje o sal em um copo e mexa a água para dissolver. Isso criará uma solução salina. - O cloreto de sódio (ou seja, sal de cozinha) é um eletrólito que aumenta a condutividade elétrica da água. Por si só, a água não conduz bem a eletricidade.
- Depois de aumentar a condutividade elétrica da água, a corrente criada pela bateria passará mais facilmente pela solução e mais efetivamente quebrará as moléculas em hidrogênio e oxigênio.
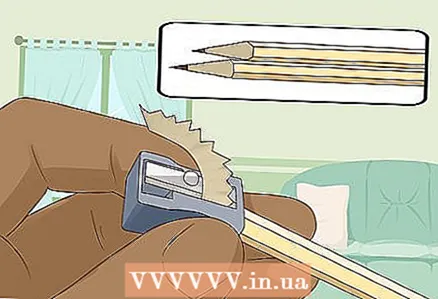 3 Afie dois lápis macios em ambas as extremidades para expor a grafite. Não se esqueça de remover a borracha de seus lápis. Uma haste de grafite deve se projetar em ambas as extremidades.
3 Afie dois lápis macios em ambas as extremidades para expor a grafite. Não se esqueça de remover a borracha de seus lápis. Uma haste de grafite deve se projetar em ambas as extremidades. - As hastes de grafite servirão como eletrodos isolados aos quais você conecta a bateria.
- O grafite é adequado para este experimento porque não se dissolve ou corrói na água.
 4 Corte uma folha de papelão grande o suficiente para colocar em cima do vidro. Use um pedaço de papelão bem grosso que não ceda depois de fazer dois furos. Corte um pedaço quadrado de uma caixa de sapatos ou algo semelhante.
4 Corte uma folha de papelão grande o suficiente para colocar em cima do vidro. Use um pedaço de papelão bem grosso que não ceda depois de fazer dois furos. Corte um pedaço quadrado de uma caixa de sapatos ou algo semelhante. - O papelão é usado para segurar os lápis na água de forma que eles não toquem nas laterais e no fundo do copo.
- O papelão não é condutor, portanto, você pode colocá-lo com segurança sobre um vidro.
 5 Use lápis para fazer dois furos no papelão. Perfure o papelão com lápis - neste caso, eles ficarão bem presos e não escorregarão. Certifique-se de que o grafite não toque nas laterais ou no fundo do vidro, caso contrário, interferirá no experimento.
5 Use lápis para fazer dois furos no papelão. Perfure o papelão com lápis - neste caso, eles ficarão bem presos e não escorregarão. Certifique-se de que o grafite não toque nas laterais ou no fundo do vidro, caso contrário, interferirá no experimento.
Parte 2 de 2: conduza um experimento
 1 Conecte um fio com garras jacaré a cada terminal da bateria. A bateria servirá como fonte de corrente elétrica e, através dos fios com pinças e hastes de grafite, a corrente chegará à água.Conecte um fio com uma braçadeira ao terminal positivo e o outro ao terminal negativo da bateria.
1 Conecte um fio com garras jacaré a cada terminal da bateria. A bateria servirá como fonte de corrente elétrica e, através dos fios com pinças e hastes de grafite, a corrente chegará à água.Conecte um fio com uma braçadeira ao terminal positivo e o outro ao terminal negativo da bateria. - Use uma bateria de 6 volts. Se você não tiver uma, pode usar uma bateria de 9 volts.
- Uma bateria adequada pode ser obtida em uma loja de material elétrico ou supermercado.
 2 Conecte as outras pontas dos fios aos lápis. Prenda as braçadeiras de fio de metal firmemente às hastes de grafite. Você pode precisar retirar um pouco mais de madeira dos lápis para evitar que os clipes deslizem das hastes de grafite.
2 Conecte as outras pontas dos fios aos lápis. Prenda as braçadeiras de fio de metal firmemente às hastes de grafite. Você pode precisar retirar um pouco mais de madeira dos lápis para evitar que os clipes deslizem das hastes de grafite. - Assim, você fechará o circuito e a corrente da bateria fluirá pela água.
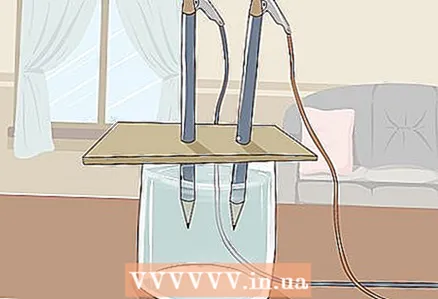 3 Coloque o papelão sobre o vidro de forma que as pontas livres dos lápis fiquem submersas na água. A folha de papelão deve ser grande o suficiente para repousar sobre o vidro. Tenha cuidado para não atrapalhar o posicionamento correto dos lápis.
3 Coloque o papelão sobre o vidro de forma que as pontas livres dos lápis fiquem submersas na água. A folha de papelão deve ser grande o suficiente para repousar sobre o vidro. Tenha cuidado para não atrapalhar o posicionamento correto dos lápis. - Para que o experimento seja bem-sucedido, o grafite não deve tocar nas paredes e no fundo do vidro. Verifique novamente e ajuste os lápis, se necessário.
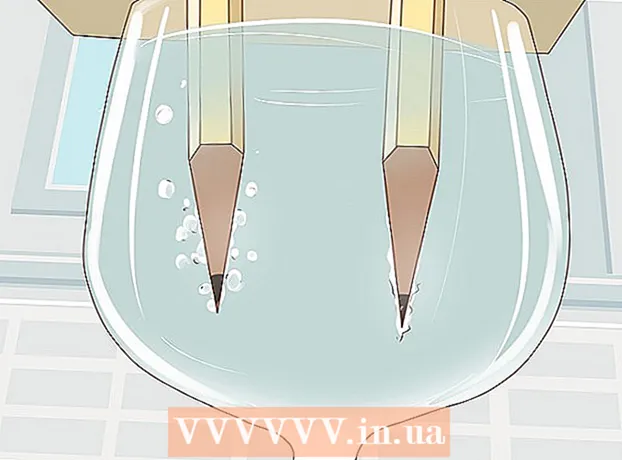
 4 Observe a água se dividir em hidrogênio e oxigênio. Bolhas de gás começarão a subir das hastes de grafite imersas na água. Estes são hidrogênio e oxigênio. O hidrogênio será liberado no pólo negativo e o oxigênio no pólo positivo.
4 Observe a água se dividir em hidrogênio e oxigênio. Bolhas de gás começarão a subir das hastes de grafite imersas na água. Estes são hidrogênio e oxigênio. O hidrogênio será liberado no pólo negativo e o oxigênio no pólo positivo. - Assim que você conectar os fios à bateria e às hastes de grafite, uma corrente elétrica fluirá pela água.
- Mais bolhas de gás se formarão no lápis que está conectado ao pólo negativo, uma vez que cada molécula de água é composta por dois átomos de hidrogênio e um átomo de oxigênio.
Pontas
- Se você não tiver lápis com hastes de grafite, poderá usar dois pequenos fios. Basta enrolar uma extremidade de cada fio em torno do pólo da bateria correspondente e mergulhar a outra na água. O resultado será o mesmo do lápis.
- Tente usar uma bateria diferente. A quantidade de corrente que flui depende da voltagem da bateria, que, por sua vez, afeta a taxa de divisão das moléculas de água.
Avisos
- Se você adicionar um eletrólito, como o sal, à água, lembre-se de que o experimento gerará uma pequena quantidade de um subproduto, como o cloro. É seguro em pequenas quantidades, mas você pode sentir um leve cheiro de cloro.
- Realize este experimento sob a supervisão de um adulto. Ele está associado à eletricidade e gases e, portanto, pode ser perigoso, embora improvável.
O que você precisa
- Dois lápis macios
- Uma bateria de 6 ou 9 volts
- Vidro com um volume de 350 mililitros
- 2 fios com clipes de crocodilo
- Apontador para lápis
- Sal



