Autor:
Lewis Jackson
Data De Criação:
12 Poderia 2021
Data De Atualização:
1 Julho 2024
Contente
Configuração de elétron de um átomo é uma série de números que representam os orbitais do elétron. Elétron Obitans são as regiões espaciais de diferentes formas em torno do núcleo de um átomo, nas quais os elétrons são organizados de maneira ordenada. Por meio da configuração do elétron, você pode determinar rapidamente quantos orbitais de elétrons existem no átomo e o número de elétrons em cada orbital. Depois de compreender os princípios básicos da configuração do elétron, você poderá escrever sua própria configuração do elétron e fazer testes químicos com confiança.
Passos
Método 1 de 2: Determine o número de elétrons usando uma tabela química periódica
Encontre o número atômico do átomo. Cada átomo tem um número específico de elétrons associados a ele. Localize o elemento na tabela periódica. O número atômico é um número inteiro positivo começando em 1 (para hidrogênio) e aumentando em 1 para cada átomo daí em diante. O número atômico é o número de prótons do átomo - portanto, também é o número de elétrons do átomo no estado fundamental.
- Determine a carga do átomo. Um átomo eletricamente neutro tem o número correto de elétrons, conforme mostrado na tabela periódica. No entanto, um átomo com carga terá mais ou menos elétrons com base na magnitude de sua carga. Se você estiver trabalhando com átomos com carga, adicione ou subtraia o número correspondente de elétrons: adicione um elétron para cada carga negativa e subtraia um elétron para cada carga positiva.
- Por exemplo, um átomo de sódio com carga +1 terá um elétron removido do número atômico base 11. Portanto, o átomo de sódio terá um total de 10 elétrons.
- Memorize a lista orbital básica. Quando um átomo recebe elétrons, esses elétrons são organizados em orbitais em uma ordem específica. Quando os elétrons preenchem os orbitais, o número de elétrons em cada orbital é par. Temos os seguintes orbitais:
- Obitan s (qualquer número com um "s" atrás da configuração do elétron) tem apenas um orbital, e segue O Princípio de Exceções de PauliCada orbital contém no máximo 2 elétrons, então cada orbital s contém apenas 2 elétrons.
- Obitan p tem 3 orbitais, portanto, pode conter até 6 elétrons.
- Obitan d tem 5 orbitais, portanto, pode conter até 10 elétrons.
- Obitan f tem 7 orbitais, portanto pode conter até 14 elétrons. Memorize a ordem dos orbitais de acordo com a seguinte frase cativante:
Sem Pagressivo Duh FOK Gdormente HOpa ÍKEu venho.
Para átomos com mais elétrons, os orbitais continuam a ser escritos em ordem alfabética após a letra k, deixando de fora os caracteres que foram usados.
- Compreenda a configuração do elétron. As configurações de elétrons são escritas para mostrar claramente o número de elétrons no átomo, bem como o número de elétrons em cada orbital. Cada orbital é escrito em uma determinada ordem, com o número de elétrons em cada orbital escrito acima à direita do nome do orbital. Finalmente, a configuração do elétron é uma sequência que consiste nos nomes dos orbitais e no número de elétrons escritos acima à direita deles.
- O exemplo a seguir é uma configuração simples de elétrons: 1s 2s 2p. Essa configuração mostra que há dois elétrons no orbital 1s, dois elétrons no orbital 2s e seis elétrons no orbital 2p. 2 + 2 + 6 = 10 elétrons (total). Esta configuração eletrônica é para um átomo de néon eletricamente neutro (o número atômico do néon é 10).
- Memorize a ordem dos orbitais. Observe que os orbitais são numerados de acordo com a classe do elétron, mas são ordenados energeticamente. Por exemplo, o 4s é saturado com uma energia inferior (ou mais durável) do que o orbital 3d saturado ou insaturado, então a subclasse 4s é escrita primeiro. Depois de saber a ordem dos orbitais, você pode organizar os elétrons neles de acordo com o número de elétrons no átomo. A ordem para colocar elétrons em orbitais é a seguinte: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- A configuração eletrônica de um átomo com cada orbital cheio de elétrons é escrita assim: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Observe que se todas as camadas forem preenchidas, a configuração de elétrons acima é a de Og (Oganesson), 118, que é o átomo de maior número na tabela periódica - contendo todas as camadas de elétrons atualmente conhecidas para com um átomo eletricamente neutro.
- Classifique os elétrons em orbitais de acordo com o número de elétrons no átomo. Por exemplo, se você quiser escrever a configuração eletrônica do átomo de cálcio eletricamente neutro, a primeira coisa a fazer é encontrar seu número atômico na tabela periódica. O número atômico do cálcio é 20, então escreveremos a configuração de um átomo com 20 elétrons na ordem acima.
- Coloque seus elétrons em orbitais na ordem acima até chegar aos 20 elétrons. Obitan 1s obtém dois elétrons, 2s obtém dois, 2p obtém seis, 3s obtém dois, 3p obtém seis e 4s obtém dois (2 + 2 + 6 +2 +6 + 2 = 20). Portanto, a configuração eletrônica do cálcio é: 1s 2s 2p 3s 3p 4s.
- Nota: O nível de energia muda conforme a camada de elétrons aumenta. Por exemplo, quando você escreve para o nível de energia 4, a subclasse 4s é escrita primeiro, mais tarde a 3d. Depois de escrever o quarto nível de energia, você passará para o quinto nível e reiniciará a ordem de camadas. Isso só acontece após o terceiro nível de energia.
- Use a tabela periódica como um atalho visual. Você deve ter notado que a forma da tabela periódica corresponde à ordem dos orbitais na configuração eletrônica. Por exemplo, átomos na segunda coluna à esquerda sempre terminam em "s", átomos na extremidade direita da seção do meio sempre terminam em "d", etc. Use a tabela periódica para escrever estruturas. figura - a ordem em que os elétrons são colocados em orbitais corresponderá às posições mostradas na tabela periódica. Ver abaixo:
- As duas colunas mais à esquerda são átomos cuja configuração de elétrons termina no orbital s, a parte direita da tabela periódica são os átomos com uma configuração de elétrons terminando no orbital p, a parte do meio são os átomos que terminam no orbital s. d, e abaixo estão os átomos que terminam no orbital f.
- Por exemplo, ao escrever configurações de elétrons para o elemento cloro, faça o seguinte argumento: Este átomo está na terceira linha (ou "período") da tabela periódica. Também está na quinta coluna do bloco orbital p da tabela periódica. Portanto, a configuração do elétron vai acabar ... 3p.
- Cuidado! As classes orbitais d e f da tabela periódica correspondem a níveis de energia diferentes de seu período. Por exemplo, a primeira linha do bloco orbital d corresponde ao orbital 3d, embora esteja no período 4, enquanto a primeira linha do orbital f corresponde ao orbital 4f, embora esteja no período 6.
- Aprenda como escrever configurações de elétrons recolhíveis. Os átomos ao longo da borda direita da tabela periódica são chamados gás raro. Esses elementos são quimicamente muito inertes. Para encurtar o caminho para escrever configurações de elétrons longas, escreva entre colchetes o símbolo químico para o gás raro mais próximo que tem menos elétrons que o do átomo, e então continue a escrever as configurações de elétrons dos próximos orbitais. . Ver abaixo:
- Para entender esse conceito, escreva um exemplo de configuração de elétrons colapsados. Suponha que precisamos escrever a configuração eletrônica para a redução do zinco (número atômico 30) por meio de uma configuração de gás raro. A configuração eletrônica completa do zinco é: 1s 2s 2p 3s 3p 4s 3d. Observe, entretanto, que 1s 2s 2p 3s 3p é a configuração para o gás agônico raro. Basta substituir esta parte da notação eletrônica do zinco pelo símbolo químico agônico entre colchetes ().
- Portanto, a configuração eletrônica do zinco é compacta 4s 3d.
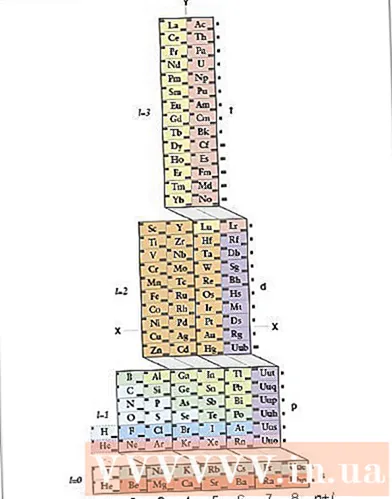
Método 2 de 2: usando a tabela periódica ADOMAH

Explore a tabela periódica ADOMAH. Este método de escrever a configuração eletrônica não requer memorização. Porém, esse método requer uma tabela periódica reorganizada, pois em uma tabela periódica regular, desde a quarta linha, o número de ciclos não corresponde à camada de elétrons. Encontre uma Tabela Periódica ADOMAH, uma tabela química periódica especial projetada pelo cientista Valery Tsimmerman. Você pode encontrar esta tabela periódica na internet.- Na Tabela Periódica ADOMAH, as linhas horizontais são grupos de elementos como halogênios, gases inertes, metais alcalinos, metais alcalino-terrosos etc. As colunas verticais correspondem à camada de elétrons e são chamadas de "degraus" (junções diagonais). os blocos s, p, d e f) correspondem ao período.
- O hélio é organizado próximo ao hidrogênio porque ambos têm um orbital 1s único. Os blocos periódicos (s, p, d e f) são mostrados no lado direito e o número de camadas de elétrons é mostrado na base. Os nomes dos elementos são escritos em um retângulo numerado de 1 a 120. Esses números são os números atômicos usuais, representando o número total de elétrons em um átomo eletricamente neutro.
- Encontre os elementos na tabela periódica ADOMAH. Para escrever uma configuração eletrônica de um elemento, localize seu símbolo na Tabela Periódica ADOMAH e risque todos os elementos com números atômicos mais altos. Por exemplo, se você quiser escrever a configuração eletrônica de eribi (68), risque os elementos 69 a 120.
- Observe os números de 1 a 8 na base da tabela periódica. Este é o número de camadas ou colunas de elétrons. Não preste atenção às colunas que têm apenas elementos riscados.Para eribi, as colunas restantes são 1, 2, 3, 4, 5 e 6.
- Conte o número de orbitais até a posição do átomo para escrever a configuração. Observe o símbolo de bloco mostrado à direita da tabela periódica (s, p, de f) e observe o número de colunas mostrado na base da tabela, independentemente das linhas diagonais entre os blocos, divida as colunas em blocos de colunas e escreva eles estão em ordem de baixo para cima. Pule blocos de colunas contendo apenas elementos riscados. Anote os blocos de colunas começando com o número da coluna e então o símbolo do bloco, como este: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (no caso de eribi).
- Nota: A configuração eletrônica acima para Er é escrita em ordem crescente do número de camadas de elétrons. Essa configuração também pode ser escrita na ordem de colocação de elétrons em orbitais. Siga as etapas de cima para baixo em vez de colunas ao escrever blocos de colunas: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Conte o número de elétrons por orbital. Conte o número de elétrons que não estão riscados em cada bloco de coluna, atribua um elétron por elemento e escreva o número de elétrons ao lado do símbolo do bloco para cada coluna do bloco, como este: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Neste exemplo, esta é a configuração eletrônica do eribi.
- Reconhecer configurações eletrônicas anormais. Existem dezoito exceções comuns à configuração eletrônica dos átomos no estado de menor energia, também conhecido como estado fundamental. Em comparação com a regra geral, eles apenas se desviam das últimas duas a três posições do elétron. Nesse caso, a configuração real do elétron faz com que os elétrons tenham um estado de energia inferior do que a configuração padrão do átomo. Os átomos incomuns são:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); D'us (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); º (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); você (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) e Cm (..., 5f7, 6d1, 7s2).
Adendo
- Quando o átomo é um íon, significa que o número de prótons não é igual ao número de elétrons. A carga do átomo é então mostrada no (geralmente) canto superior direito do símbolo do elemento. Portanto, um átomo de antimônio com carga +2 terá uma configuração eletrônica de 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Observe que 5p é alterado para 5p. Tenha cuidado quando a configuração de um átomo eletricamente neutro terminar em qualquer orbital diferente de s e p. Com os elétrons removidos, você só pode retirar elétrons dos orbitais de valência (orbitais s e p). Portanto, se uma configuração termina em 4s 3d e o átomo tem uma carga de +2, a configuração muda para 4s 3d. Vemos 3dconstante, mas apenas os elétrons no orbital s são removidos.
- Todos os átomos tendem a retornar a um estado estável, e a configuração eletrônica mais estável terá orbitais s e p suficientes (s2 e p6). Esses gases raros têm essa configuração eletrônica, por isso raramente participam de reações e ficam do lado direito da tabela periódica. Portanto, se uma configuração termina em 3p, ela só precisa adicionar mais dois elétrons para se tornar estável (distribuir seis elétrons, incluindo os do orbital s, exigiria mais energia, portanto, distribuir quatro elétrons seria fácil. Mais fácil). Se uma configuração termina em 4d, ela só precisa doar três elétrons para atingir um estado estável. Da mesma forma, novas subclasses que recebem metade dos elétrons (s1, p3, d5 ..) são mais estáveis, por exemplo, p4 ou p2, mas s2 e p6 serão ainda mais estáveis.
- Você também pode usar a configuração de elétrons de valência para escrever a configuração de elétrons de um elemento, que são os últimos orbitais s e p. Portanto, a configuração de valência de um átomo de antimônio para um antimônio é 5s 5p.
- Os íons não gostam disso porque são muito mais duráveis. Pule as duas etapas acima deste artigo e trabalhe da mesma maneira, dependendo de onde você começou e de quantos ou menos elétrons você tem.
- Para encontrar o número atômico de sua configuração eletrônica, some todos os números que seguem as letras (s, p, d e f). Isso só é correto se for um átomo neutro, se for um íon, então você não pode usar este método. Em vez disso, você deve adicionar ou subtrair o número de elétrons que recebe ou distribui.
- O número após a letra deve ser escrito no canto superior direito, você não deve escrever incorretamente ao fazer o teste.
- Existem duas maneiras diferentes de escrever configurações eletrônicas. Você pode escrever na ordem crescente da camada de elétrons ou na ordem em que os elétrons são colocados em orbitais, como mostrado para o átomo de eribi.
- Existem casos em que um elétron precisa ser "empurrado para cima". Isto é, quando um orbital tem apenas um elétron faltando para ter metade ou todos os elétrons, então você deve pegar um elétron do orbital s ou p mais próximo para transferi-lo para o orbital que precisa desse elétron.
- Não podemos dizer que a "estabilidade da fração de energia" da subclasse recebe metade dos elétrons. Isso é uma simplificação excessiva. A razão para a estabilidade do nível de energia da nova subclasse que recebe "metade dos elétrons" é que cada orbital tem apenas um único elétron, portanto a repulsão elétron-elétron é minimizada.



