Autor:
Randy Alexander
Data De Criação:
1 Abril 2021
Data De Atualização:
1 Julho 2024
Contente
Na quimica, elétrons de valência são elétrons localizados na camada mais externa da camada de elétrons de um elemento. Determinar o número de elétrons de valência de um elemento é uma habilidade importante na química porque essa informação ajudará a determinar os tipos de ligações que esse elemento pode formar. A determinação do número de elétrons de valência pode ser feita facilmente com a tabela periódica de elementos químicos.
Passos
Parte 1 de 2: Encontre o número de elétrons de valência usando a tabela periódica
Com metal não de transição
Tenha um pronto tabela periódica elementos químicos. A tabela periódica de elementos (a tabela periódica para breve) é uma tabela multicelular codificada por cores que lista todos os elementos conhecidos, bem como algumas informações essenciais sobre esses elementos. Com base nas informações disponíveis na tabela periódica, podemos determinar o número de elétrons de valência do elemento que estamos investigando. A tabela periódica geralmente é anexada a um livro didático. Você também pode consultar esta tabela periódica interativa existente.

Numere cada coluna da tabela periódica de 1 a 18. Normalmente, na tabela periódica, todos os elementos da mesma coluna terão o mesmo número de elétrons de valência. Se a sua tabela periódica ainda não numerou colunas, faça você mesmo numerando de 1 a 18 verticalmente da esquerda para a direita. Cientificamente, cada coluna da tabela periódica é chamada de um "grupo".- Por exemplo, para uma tabela periódica sem sinal, numeraríamos 1 acima do elemento Hidrogênio (H), o número 2 acima do elemento Beri (Be) e faríamos o mesmo até 18 acima do Hélio (He )

Determine a posição do elemento em questão. Nesta etapa, determine a posição do elemento que você está vendo na tabela periódica. Você pode encontrar a posição de um elemento com base em seu símbolo químico (letra em cada célula), número atômico (o número no canto superior esquerdo de cada célula) ou com base nas informações as mensagens estão disponíveis na tabela periódica.- Por exemplo, precisamos encontrar o número de elétrons de valência do elemento Carbono (C). O número atômico do elemento é 6. O carbono está na parte superior dos elementos do grupo 14. Na próxima etapa iremos determinar o número de elétrons de valência deste elemento.
- Nesta seção, iremos ignorar os metais de transição, ou seja, elementos na faixa dos grupos 3 a 12. Esses metais de transição são ligeiramente diferentes dos demais, portanto, as etapas são As instruções fornecidas nesta seção não se aplicam a esses metais. Veremos esses grupos de elementos posteriormente neste artigo.

Use o número do grupo para determinar o número de elétrons de valência. O número do grupo de um metal não de transição pode ser usado para calcular o número de elétrons de valência no átomo desse elemento. A "linha unitária do número do grupo" é o número de elétrons de valência presentes nos átomos dos elementos desse grupo. Em outras palavras:- Grupo 1: 1 elétron de valência
- Grupo 2: 2 elétrons de valência
- Grupo 13: 3 elétrons de valência
- Grupo 14: 4 elétrons de valência
- Grupo 15: 5 elétrons de valência
- Grupo 16: 6 elétrons de valência
- Grupo 17: 7 elétrons de valência
- Grupo 18: 8 elétrons de valência (exceto para hélio com 2 elétrons de valência)
- No exemplo do carbono, uma vez que o carbono está no grupo 14, podemos dizer que um átomo de carbono tem quatro elétrons de valência.
Com metal de transição
Identifique um elemento no intervalo do Grupo 3 ao Grupo 12. Como mencionado acima, os elementos dos grupos 3 a 12 são chamados de "metais de transição" e quando se trata de elétrons de valência, eles têm propriedades diferentes dos demais. Nesta seção, aprenderemos por que muitas vezes não é possível atribuir elétrons de valência aos átomos de metais de transição.
- Nesta seção, tomamos o elemento Tantan (Ta) cujo número atômico é 73 como exemplo. As próximas etapas ajudarão a determinar o número de elétrons de valência do elemento.
- Observe que os elementos das três famílias lantans e actinium (também conhecidos como "metais de terras raras") também pertencem ao grupo dos metais de transição - esses dois grupos de elementos são geralmente listados abaixo da tabela periódica. cabeça com lantan e actini.
Os elétrons de valência em metais de transição não são iguais aos elétrons de valência 'normais'. Para entender por que os metais de transição não "funcionam" como outros elementos da tabela periódica, precisamos saber um pouco sobre como os elétrons funcionam no átomo, conforme explicado abaixo. , ou você pode pular esta etapa.
- Quando os elétrons são inseridos em um átomo, eles são organizados em diferentes "orbitais" - isto é, diferentes regiões ao redor do núcleo. Em suma, os elétrons de valência são os elétrons localizados na camada orbital mais externa - em outras palavras, os últimos elétrons adicionados ao átomo.
- Explicar o orbital em detalhes talvez seja um pouco complicado, quando os elétrons são adicionados à subclasse d da camada atômica do metal de transição (veja abaixo), o primeiro desses elétrons se comportará como elétrons de valência convencionais, mas então suas propriedades podem mudar, o dobro quando os elétrons de outros orbitais podem atuar como elétrons de valência. Ou seja, um átomo pode ter vários elétrons de valência, dependendo do caso.
- Você pode aprender mais sobre isso no site de elétrons de valência do Clackamas Community College.
Determine o número de elétrons de valência com base no número do grupo. Como observado acima para metais não de transição, o número do grupo na tabela periódica pode ajudar a determinar o número de elétrons de valência. No entanto, não existe uma fórmula definida para determinar o número exato de elétrons de valência do metal de transição - neste caso, o número de elétrons de valência de um elemento não está em um valor fixo, o número de coisas. os grupos próprios podem dizer apenas um número relativo de elétrons de valência. Detalhe:
- Grupo 3: 3 elétrons de valência
- Grupos de 4: 2 a 4 elétrons de valência
- Grupo 5: 2 a 5 elétrons de valência
- Grupo 6: 2 a 6 elétrons de valência
- Grupos 7: 2 a 7 elétrons de valência
- Grupos de 8: 2 a 3 elétrons de valência
- Grupos 9: 2 a 3 elétrons de valência
- Grupos de 10: 2 a 3 elétrons de valência
- Grupos 11: 1 a 2 elétrons de valência
- Grupo 12: 2 elétrons de valência
- Tomando o exemplo do elemento Tanta (Ta) do grupo 5, podemos dizer que este elemento possui de 2 a 5 elétrons de valência, dependendo do caso.
Parte 2 de 2: Encontre o número de elétrons de valência com base na configuração do elétron
Aprenda a ler a configuração eletrônica. Com base na configuração eletrônica de um elemento, também podemos determinar o número de elétrons de valência desse elemento. A configuração do elétron parece complicada, mas é apenas como representar os orbitais de um elemento na forma de letras e números, uma vez que você tenha entendido a lei, entender a configuração do elétron não é difícil.
- Considere um exemplo de configuração de elétrons de sódio (Na):
- 1s2s2p3s
- Se você prestar atenção, verá que a configuração do elétron é apenas uma sequência de repetições:
- (número) (palavra) (número) (palavra) ...
- ... e assim por diante. Grupo (número) (palavra) o primeiro é o nome do orbital e denota o número de elétrons naquele orbital.
- Então, no nosso caso, podemos dizer que o sódio 2 elétrons no orbital 1s, 2 elétrons no orbital 2s, 6 elétrons no orbital 2p e 1 elétron em orbital 3 3s. Existem 11 elétrons no total - o número atômico do sódio também é 11.
- Considere um exemplo de configuração de elétrons de sódio (Na):
Encontre a configuração eletrônica do elemento que você está olhando. Depois de conhecer a configuração eletrônica de um elemento, encontrar a configuração eletrônica desse elemento não é difícil (exceto no caso de metais de transição). Se a configuração de elétrons estiver disponível na questão que você precisa resolver, você pode pular esta etapa. Se você precisar encontrar a configuração do elétron, prossiga com as seguintes etapas:
- A configuração eletrônica completa do elemento ununocti (Uuo), o número atômico 118 é:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Depois de ter essa configuração eletrônica completa, para encontrar a configuração eletrônica de outro elemento, você só precisa preencher os orbitais com elétrons, começando com o primeiro orbital, até que o número de elétrons se esgote para preencher. Parece complicado, mas quando se trata de fazer isso é relativamente fácil. Por exemplo, se quiséssemos escrever a configuração eletrônica completa do cloro (Cl), elemento 17, ou seja, o átomo deste elemento tem 17 elétrons, preencheríamos o seguinte:
- 1s2s2p3s3p
- Observe que o número total de elétrons na configuração do elétron está certo 17: 2 + 2 + 6 + 2 + 5 = 17. Você só precisa alterar o número no último orbital - o resto permanece o mesmo porque o quase penúltimo orbital está cheio. elétron.
- Saiba mais sobre como escrever a configuração eletrônica de um elemento.
- A configuração eletrônica completa do elemento ununocti (Uuo), o número atômico 118 é:

Atribua elétrons a orbitais de acordo com a Oitava Regra. Quando os elétrons são adicionados a um átomo, eles são classificados em orbitais na ordem indicada acima - os primeiros dois elétrons serão colocados no orbital 1s, os próximos dois elétrons no orbital 2s, os próximos seis elétrons são colocados no orbital 2p, faça-o até que o elétron seja colocado no orbital correspondente. Quando consideramos os átomos de elementos de não transição, podemos dizer que esses orbitais formarão "camadas" ao redor do núcleo, nas quais a camada posterior estará mais longe do núcleo do que a anterior. Além da primeira camada orbital, que pode conter apenas até dois elétrons, todas as camadas orbitais subsequentes podem conter até oito elétrons (exceto no caso de metais de transição). Esta regra é chamada A regra óctupla.- Por exemplo, considere o elemento Bo (B). O número atômico desse elemento é 5, então temos a configuração eletrônica desse elemento da seguinte forma: 1s2s2p. Como a primeira camada orbital contém apenas 2 elétrons, é possível determinar que Bo possui duas camadas orbitais: a primeira consistindo de 2 elétrons no orbital 1s e a segunda com três elétrons distribuídos nos orbitais 2s e 2p. .
- Para outro exemplo, um elemento semelhante ao cloro teria 3 camadas: uma camada de dois elétrons no orbital 1s, uma camada de dois elétrons no orbital 2s e seis elétrons no orbital 2p e uma camada externa de dois elétrons no orbital 3s. e cinco elétrons em um orbital 3p.

Encontre o número de elétrons na camada mais externa. Uma vez que a configuração do elétron foi determinada, já conhecemos as camadas desse elemento, encontrar o número de elétrons de valência pode ser feito determinando o número de elétrons na camada mais externa da camada de elétrons atômica. Se a camada mais externa estiver cheia (ou seja, já com um total de oito elétrons, ou para a primeira camada 2 elétrons), esse elemento é chamado de elemento inerte e dificilmente está envolvido em reações químicas. No entanto, esta regra não se aplica a metais de transição.- Por exemplo Bo, uma vez que Bo tem três elétrons na segunda camada, também a camada mais externa, podemos dizer que o elemento Bo tem pai elétrons de valência.

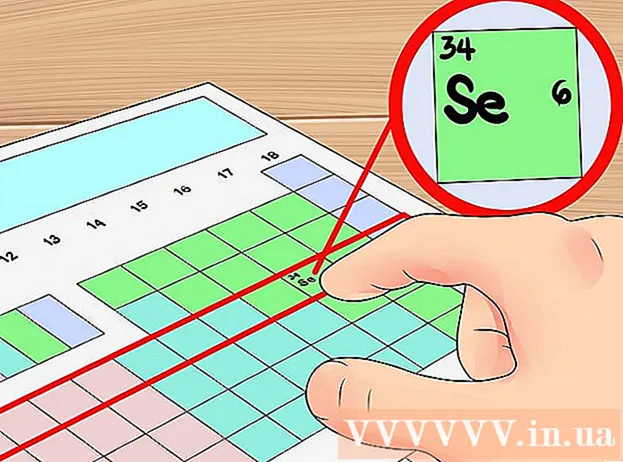
Use o número da linha na tabela periódica como uma forma abreviada de determinar o número de camadas orbitais. A linha horizontal na tabela periódica é chamada "ciclo" dos elementos. A partir da primeira linha, cada ciclo corresponde ao 'número de camadas de elétrons' dos elementos no mesmo período. Portanto, você pode usar o período para determinar rapidamente o número de elétrons de valência de um elemento - você apenas conta o número de elétrons da esquerda para a direita a partir do primeiro elemento desse período. Observe mais uma vez que isso não se aplica a metais de transição.- Por exemplo, como o selênio pertence ao ciclo 4, pode-se determinar que o elemento possui quatro camadas de elétrons na camada atômica. Visto que, da esquerda para a direita, este é o sexto elemento no ciclo 4 (excluindo o metal de transição), podemos dizer que a quarta camada de selênio tem seis elétrons, ou seja, este elemento tem seis elétrons de valência.
Adendo
- Observe que a configuração do elétron pode ser escrita resumidamente usando gases raros (elementos do grupo 18) em vez de orbitais no topo da configuração. Por exemplo, a configuração eletrônica do sódio pode ser escrita como 3s1 - isto é, a configuração eletrônica do sódio é a mesma do néon, mas há um elétron extra no orbital 3s.
- Os metais de transição podem ter subclasses de valência incompletas. Para determinar com precisão o número de valência do metal de transição, é necessário empregar princípios quânticos complexos que não são cobertos por este artigo.
- Também é importante notar que a tabela periódica de elementos químicos pode ser diferente em diferentes países. Portanto, certifique-se de usar a tabela periódica comum de onde você mora para evitar confusão.
O que você precisa
- Tabela periódica de elementos químicos
- Lápis
- Papel