Autor:
Helen Garcia
Data De Criação:
21 Abril 2021
Data De Atualização:
1 Julho 2024
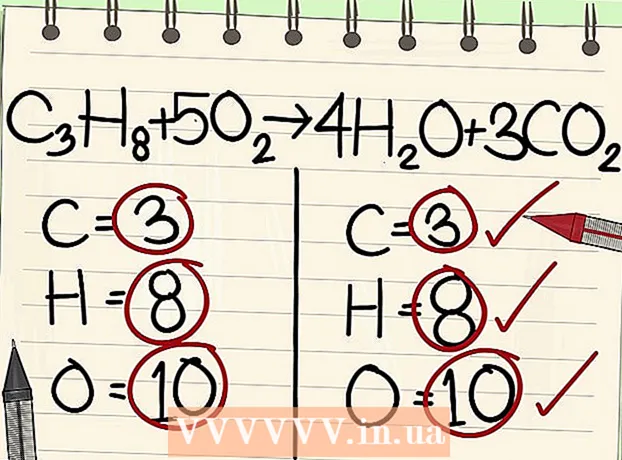
Contente
Uma equação química é uma representação simbólica de uma reação química. Neste caso, os compostos reagentes (reagentes) são escritos à esquerda, e as substâncias resultantes (produtos de reação) - no lado direito da equação. Uma seta é colocada entre eles da esquerda para a direita, que indica a direção da reação. De acordo com a lei da conservação da massa, no curso de uma reação química, novos átomos não podem aparecer ou os antigos desaparecer; portanto, o número de átomos nos reagentes deve ser igual ao número de átomos nos produtos da reação química . Este artigo descreve como equilibrar equações químicas usando métodos diferentes.
Passos
Método 1 de 2: Método tradicional
 1 Escreva uma equação química. Como exemplo, considere a seguinte reação:
1 Escreva uma equação química. Como exemplo, considere a seguinte reação: - C3H8 + O2 -> H2O + CO2
- Esta reação descreve a combustão de propano (C3H8) na presença de oxigênio para formar água e dióxido de carbono (dióxido de carbono).
 2 Anote o número de átomos de cada elemento. Faça isso para ambos os lados da equação. Observe os subscritos ao lado de cada elemento para determinar o número total de átomos. Escreva o símbolo para cada elemento na equação e observe o número correspondente de átomos.
2 Anote o número de átomos de cada elemento. Faça isso para ambos os lados da equação. Observe os subscritos ao lado de cada elemento para determinar o número total de átomos. Escreva o símbolo para cada elemento na equação e observe o número correspondente de átomos. - Por exemplo, no lado direito da equação em consideração, como resultado da adição, obtemos 3 átomos de oxigênio.
- No lado esquerdo, temos 3 átomos de carbono (C3), 8 átomos de hidrogênio (H8) e 2 átomos de oxigênio (O2).
- No lado direito temos 1 átomo de carbono (C), 2 átomos de hidrogênio (H2) e 3 átomos de oxigênio (O + O2).
 3 Guarde o hidrogênio e o oxigênio para depois, pois eles fazem parte de vários compostos nos lados esquerdo e direito. O hidrogênio e o oxigênio são parte de várias moléculas, então é melhor equilibrá-los por último.
3 Guarde o hidrogênio e o oxigênio para depois, pois eles fazem parte de vários compostos nos lados esquerdo e direito. O hidrogênio e o oxigênio são parte de várias moléculas, então é melhor equilibrá-los por último. - Antes de equilibrar hidrogênio e oxigênio, você terá que recontar os átomos novamente, pois fatores adicionais podem ser necessários para equilibrar outros elementos.
 4 Comece com o item menos frequente. Se você precisar equilibrar vários elementos, escolha um que faça parte de uma molécula de reagente e uma molécula de produtos de reação. Portanto, o carbono deve ser equilibrado primeiro.
4 Comece com o item menos frequente. Se você precisar equilibrar vários elementos, escolha um que faça parte de uma molécula de reagente e uma molécula de produtos de reação. Portanto, o carbono deve ser equilibrado primeiro.  5 Para equilíbrio, adicione um fator na frente de um único átomo de carbono. Coloque um fator na frente do carbono único no lado direito da equação para equilibrá-lo com 3 carbonos no lado esquerdo.
5 Para equilíbrio, adicione um fator na frente de um único átomo de carbono. Coloque um fator na frente do carbono único no lado direito da equação para equilibrá-lo com 3 carbonos no lado esquerdo. - C3H8 + O2 -> H2O + 3CO2
- Um fator de 3 na frente do carbono no lado direito da equação indica que existem três átomos de carbono, que correspondem aos três átomos de carbono na molécula de propano no lado esquerdo.
- Em uma equação química, você pode alterar os coeficientes na frente dos átomos e moléculas, mas os subscritos devem permanecer inalterados.
 6 Em seguida, equilibre os átomos de hidrogênio. Depois que você equalizou o número de átomos de carbono nos lados esquerdo e direito, o hidrogênio e o oxigênio permaneceram desequilibrados. O lado esquerdo da equação contém 8 átomos de hidrogênio, o mesmo número deve estar à direita. Consiga isso com uma proporção.
6 Em seguida, equilibre os átomos de hidrogênio. Depois que você equalizou o número de átomos de carbono nos lados esquerdo e direito, o hidrogênio e o oxigênio permaneceram desequilibrados. O lado esquerdo da equação contém 8 átomos de hidrogênio, o mesmo número deve estar à direita. Consiga isso com uma proporção. - C3H8 + O2 -> 4H2O + 3CO2
- Adicionamos um fator de 4 à direita, pois o subscrito mostra que já temos dois átomos de hidrogênio.
- Se você multiplicar o fator 4 pelo subscrito 2, obterá 8.
- Como resultado, 10 átomos de oxigênio são obtidos no lado direito: 3x2 = 6 átomos em três moléculas de 3CO2 e mais quatro átomos em quatro moléculas de água.
 7 Equilibre os átomos de oxigênio. Lembre-se de fatorar os coeficientes que você usou para equilibrar os outros átomos. Como você adicionou os coeficientes na frente das moléculas no lado direito da equação, o número de átomos de oxigênio mudou. Agora você tem 4 átomos de oxigênio nas moléculas de água e 6 átomos de oxigênio nas moléculas de dióxido de carbono. Portanto, existem 10 átomos de oxigênio no lado direito.
7 Equilibre os átomos de oxigênio. Lembre-se de fatorar os coeficientes que você usou para equilibrar os outros átomos. Como você adicionou os coeficientes na frente das moléculas no lado direito da equação, o número de átomos de oxigênio mudou. Agora você tem 4 átomos de oxigênio nas moléculas de água e 6 átomos de oxigênio nas moléculas de dióxido de carbono. Portanto, existem 10 átomos de oxigênio no lado direito. - Adicione um fator de 5 à molécula de oxigênio no lado esquerdo da equação. Cada peça agora contém 10 átomos de oxigênio.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Portanto, ambos os lados da equação contêm o mesmo número de átomos de carbono, hidrogênio e oxigênio. A equação está equilibrada.
Método 2 de 2: Método Algébrico
- 1 Escreva a equação de reação. Como exemplo, considere a seguinte reação química:
- PCl5 + H2O -> H3PO4 + HCl
- 2 Coloque uma letra na frente de cada conexão:
- umaPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Equalize o número de átomos para cada elemento nos lados esquerdo e direito da equação.
- umaPCl5 + bH2O -> cH3PO4 + dHCl
- À esquerda temos 2b átomos de hidrogênio (2 em cada H2O), enquanto à direita está 3c+d átomos de hidrogênio (3 em cada H3PO4 e 1 em cada molécula de HCl). Uma vez que os lados esquerdo e direito devem conter o mesmo número de átomos de hidrogênio, 2b deve ser igual a 3c+d.
- Faça isso para todos os elementos:
- P: uma=c
- Cl: 5uma=d
- H: 2b=3c+d
- 4 Resolva o sistema de equações para encontrar os valores numéricos dos coeficientes. O sistema possui várias soluções, pois existem mais variáveis do que equações. É necessário encontrar essa solução de forma que todos os coeficientes tenham a forma dos menores inteiros possíveis.
- Para resolver rapidamente um sistema de equações, atribua um valor numérico a uma das variáveis. Suponha que a = 1. Vamos resolver o sistema e encontrar os valores das variáveis restantes:
- Para P a = c, então c = 1
- Para Cl 5a = d, portanto d = 5
- Dado que para H 2b = 3c + d, encontramos o valor b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Assim, temos os seguintes coeficientes:
- a = 1
- b = 4
- c = 1
- d = 5
Pontas
- Se você estiver tendo dificuldades, uma calculadora online pode ser usada para equilibrar as equações químicas. Observe, entretanto, que essa calculadora não pode ser usada durante o exame, portanto, não dependa exclusivamente dela.
- Lembre-se de que às vezes a equação pode ser simplificada! Se todos os coeficientes forem divisíveis por um inteiro, simplifique a equação.
Avisos
- Para se livrar dos coeficientes fracionários, multiplique a equação inteira (seus lados esquerdo e direito) pelo denominador da fração.
- Nunca use frações como coeficientes da equação química - não existem meias moléculas ou átomos nas reações químicas.
- No processo de balanceamento, você pode usar frações por conveniência, mas a equação não é balanceada enquanto houver coeficientes fracionários nela.



