Autor:
Lewis Jackson
Data De Criação:
5 Poderia 2021
Data De Atualização:
1 Julho 2024

Contente
Mol é a unidade padrão de medida em química, usada para observar os diferentes elementos de um composto. Normalmente, a massa do composto é calculada em gramas (g) e precisa ser convertida em unidades molares. A transição é bastante simples, no entanto, ainda existem alguns passos importantes que precisamos seguir. Usando o método abaixo, você pode converter facilmente gramas em moles.
Passos
Parte 1 de 2: Calcular a massa molecular
Prepare o material necessário para resolver o problema matemático. Quando você tiver todas as ferramentas disponíveis, será mais fácil resolver o problema. O que você precisa é:
- Lápis e papel. A matemática fica mais fácil quando você escreve tudo no papel. Você precisa apresentar todas as etapas para atingir a pontuação máxima.
- Tabela periódica de elementos químicos: usada para determinar a massa dos átomos dos elementos.
- Calculadora de bolso: usada para calcular números complicados.

Determine quais elementos estão no composto que você precisa para converter em unidades molares. O primeiro passo para calcular a massa molecular é determinar os elementos que compõem o composto. Isso é fácil porque a abreviatura dos elementos é de apenas um a dois caracteres.- Se uma substância for abreviada com duas letras, a primeira letra será maiúscula e a segunda letra minúscula. Exemplo: Mg é a abreviatura do elemento magnésio.
- Compostos NaHCO3 consiste em quatro elementos: sódio (Na), hidrogênio (H), carbono (C) e oxigênio (O).
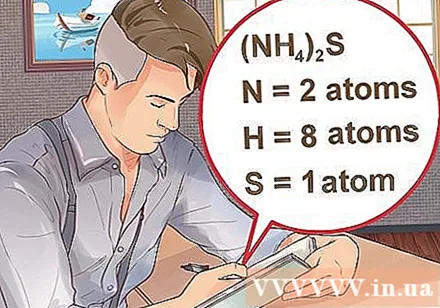
Determine o número de átomos para cada elemento do composto. Você precisa saber o número atômico de cada substância em um composto para calcular a massa da molécula desse composto. O pequeno número próximo à abreviação do elemento representa o número atômico do elemento.- Exemplo: composto H2O tem dois átomos de hidrogênio e um átomo de oxigênio.
- Se um composto for escrito entre parênteses, acompanhado de um pequeno índice, isso significa que cada ingrediente entre parênteses multiplica o índice. Exemplo: composto (NH4)2S consiste em dois átomos de N, oito átomos de H e um átomo de S.

Escreva o papel atômico cúbico para cada elemento. Usar a tabela periódica é a maneira mais fácil de encontrar o átomo cúbico de um elemento. Depois de localizar o elemento na tabela periódica, você verá a massa atômica logo abaixo do ícone do elemento.- Por exemplo, o átomo cúbico de oxigênio é 15,99.
Calcule a massa molecular. A massa da molécula de uma substância é igual ao número de átomos de cada elemento multiplicado pelo átomo da massa desse elemento. Esta quantidade é essencial na conversão grama para molar.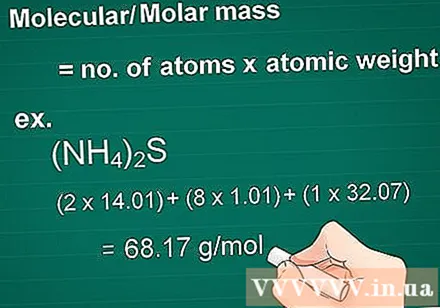
- Primeiro, multiplique o número atômico de cada elemento no composto por seu átomo de massa.
- Em seguida, adicione as massas dos elementos no composto.
- Exemplo: massa molecular de um composto (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- A massa molecular também é conhecida como massa molar.
Parte 2 de 2: converter gramas em mol
Configure a fórmula de conversão. Para encontrar o número de moles do composto, divida o número de gramas do composto pela massa molar desse composto.
- Fórmula: número de moles = massa (gramas) / massa molar do composto (grama / mol)
Substitua os números na fórmula. Depois de definir a fórmula certa, a próxima etapa é substituir os números que você calculou na fórmula. Se quiser ter certeza de que os dados estão na posição correta, você pode verificar suprimindo a unidade. Se, para simplificar, a unidade restante for moles, então você está configurado corretamente.
Resolva a equação. Usando uma calculadora, divida a massa pela molécula cúbica da substância ou composto. O quociente será o número de moles da substância ou composto que você está procurando.
- Por exemplo, você deve tomar 2 g de água (H2O) e pedir que você converta em unidades molares. Temos a massa molar de H2O é 18g / mol. Divida 2 por 18, então você tem 0,1111 mol H2O.
Adendo
- Não se esqueça de incluir o nome do elemento ou composto nas respostas.
- Se você for solicitado a apresentar um exercício ou questionário, certifique-se de mostrar suas respostas claramente, circulando ou desenhando uma caixa ao redor das respostas.
O que você precisa
- Tabela Química Periódica
- Lápis
- Papel
- Computador
- Problemas de química