Autor:
Louise Ward
Data De Criação:
11 Fevereiro 2021
Data De Atualização:
1 Julho 2024

Contente
O tamanho de um átomo é tão pequeno que é difícil medir com precisão o número atômico de um composto químico. Para ser capaz de medir com precisão uma quantidade de substâncias, os cientistas usam uma unidade de mol para representar um número específico de átomos. Um mol de substância é definido como equivalente ao número de átomos de carbono contidos em 12 gramas do isótopo de 12 carbonos, que é cerca de 6.022 x 10 átomos. Esse valor é chamado de número de Avogadro ou constante de Avogadro. Isso também é conhecido como o número de átomos em 1 mol de qualquer elemento, e 1 mol da massa de uma substância é chamada de massa molar dessa substância.
Passos
Método 1 de 2: Calcule a massa molar de um elemento
Definição de massa molar. A massa molar de uma substância é a massa (em gramas) de um mol dessa substância. Para calcular a massa molar de um elemento, multiplique sua massa atômica pelo fator de conversão grama por mol (g / mol).
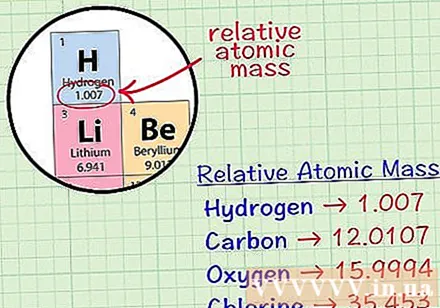
Encontre o átomo cúbico médio de um elemento. O átomo de massa média de um elemento é a massa média, em unidades atômicas, em uma amostra que inclui todos os isótopos desse elemento. Esta informação é freqüentemente fornecida na tabela periódica de elementos. Ao localizar um elemento, você pode encontrar um átomo cúbico médio escrito logo abaixo do símbolo químico do elemento. Este valor não é um número inteiro, mas um número com casas decimais.- Por exemplo, com hidrogênio, o átomo de massa média é 1,007; O átomo cúbico médio de carbono é 12.0107; A massa média do átomo de oxigênio é 15,9994; o cloro tem massa atômica média de 35.453.

Multiplique o átomo de massa média pela constante de massa molar. A unidade de deslizamento molar é definida como 0,001 quilograma por mol ou 1 grama por mol. O produto do átomo de massa média e da constante de massa molar converte a unidade de massa atômica em gramas por mol, então a massa molar do hidrogênio será 1,007 gramas por mol, para o carbono é 12. , 0107 gramas por mole, de oxigênio é 15,9995 gramas por mole, e o de cloro é 35.453 gramas por mole.- Alguns elementos existem na natureza como moléculas que consistem em dois ou mais dos mesmos átomos. Ou seja, se você deseja calcular a massa molar de compostos formados por mais de um átomo, como gás hidrogênio, gás oxigênio ou gás cloro, é necessário determinar a massa atômica média do composto e multiplicar esse valor. com a constante de massa molar, '' então '' multiplique o produto que você acabou de encontrar por 2.
- Com H2: 1.007 x 2 = 2.014 gramas por mol; para O2: 15,9994 x 2 = 31,9988 gramas por mol; e Cl2: 35.453 x 2 = 70.096 gramas por mol.
Método 2 de 2: Calcule a massa molar do composto

Determine a fórmula estrutural do composto. A fórmula estrutural de uma substância fornece o número atômico de cada elemento que compõe aquele composto. (Esta informação está disponível em todos os livros de referência). Por exemplo, a fórmula química do ácido clorídrico é HCl; de glicose é C6H12O6. Com esta fórmula estrutural, podemos determinar o número de cada tipo de átomo que constitui o composto em consideração.- Onde HCl tem um átomo de hidrogênio e um átomo de cloro.
- Molécula de açúcar glicose C6H12O6 tem 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio.
Determine o átomo de massa média de cada elemento constituinte. Use a tabela periódica para encontrar a massa média do átomo de cada elemento presente no composto. O átomo de massa média é geralmente escrito sob o símbolo químico do elemento na tabela periódica. Semelhante ao cálculo da massa molar de um elemento, multiplique a massa média do átomo por 1 grama / mol.
- A massa média do átomo dos elementos que formam o ácido clorídrico é a seguinte: hidrogênio 1.007 g / mol e cloro 35.453 g / mol.
- O átomo de massa média dos elementos que compõem a molécula de glicose é: carbono, 12.017 g / mol; hidrogênio, 1.007 g / mol; e oxigênio, 15,9995 g / mol.
Calcule a massa molar de cada elemento componente. Multiplicando a massa do átomo de um elemento pelo número de átomos que ele contribui em um composto, obtém-se a massa média do elemento no composto.
- No caso do ácido clorídrico, HCl, a massa molar do elemento hidrogênio é de 1.007 g / mol e a do cloro é de 35.453 g / mol.
- No caso da glicose, C6H12O6, a massa molar de cada elemento é a seguinte: carbono, 12.0107 x 6 = 72.0642 g / mol; hidrogênio, 1.007 x 12 = 12.084 g / mol; oxigênio, 15,9995 x 6 = 95,9964 g / mol.
Massa molar total dos elementos constituintes. A massa molar total dos elementos de compostagem é a massa molar do composto.Na etapa anterior calculamos a massa molar de cada elemento presente no composto, nesta etapa precisamos apenas somar todos esses valores.
- A massa molar de ácido clorídrico é 1.007 + 35.453 = 36.460 g / mol. 36,46 gramas é a massa de 1 mol de ácido clorídrico.
- A massa molar de glicose é 72.0642 + 12.084 + 95,9964 = 180,1446 g / mol. Portanto, cada mol de glicose tem uma massa de 180,14 gramas.
Adendo
- Embora na maioria dos casos, o átomo de massa média seja registrado com aproximação de 1 parte 1000 (4 casas decimais), em laboratórios, a massa molar é frequentemente reduzida a 2 casas decimais, às vezes até menos, para moléculas grandes. Portanto, no caso de laboratório, a massa molar do ácido clorídrico pode ser escrita como 36,46 g por mol, para a glicose 180,14 g por mol.
O que você precisa
- Livro de referência química ou tabela periódica de elementos
- Computador